研究開発部 深澤です。「R&D化学ネタ」今回も引き続き、”Nirmatrelvir (COVID-19 治療薬)”のご紹介です。
part 1
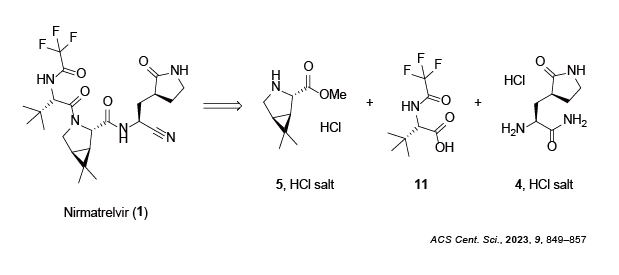
1 ) を実製造する際に使われる3つのフラグメント1 のうち、5 の塩酸塩の合成法を紹介します。
Scheme 1 実製造においてNirmatrelvir (1 ) を構成する3つのフラグメント
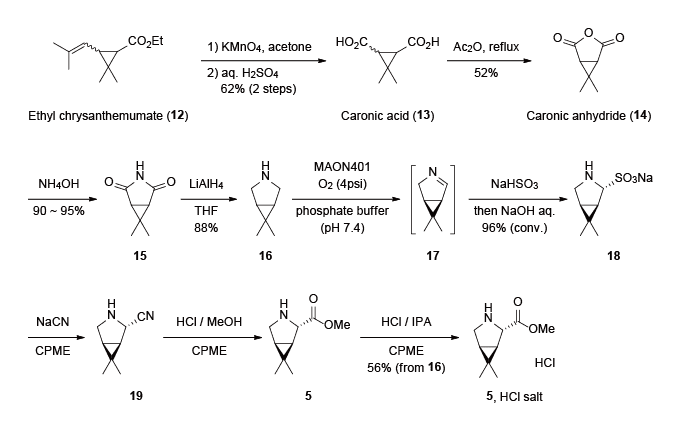
5 の塩酸塩の合成化合物5 はNirmatrelvir (1 ) 以外にもBoceprevirの部分骨格にも含まれ、製造実績があります2 。12 ) を出発原料とし、オレフィンの酸化開裂及び加水分解により、カロン酸 (13 ) を得ます。次に無水酢酸溶媒中で加熱還流することで、カロン酸無水物 (14 ) へと誘導します3 。続いてアンモニア水で処理し、イミド15 へ誘導した後、LiAlH4 還元によりピロリジン誘導体16 を得ます4 。得られた16 に対してアミン酸化酵素を用いた非対称化により中間体17 を経由してスルホン酸ナトリウム18 へと誘導します2 。最後にニトリル基の導入 (18 →19 )、加溶媒分解 (19 →5 )、塩酸塩化 (5 →5 HCl salt) により、目的とする化合物が得られます2 。
Scheme 2 5 の塩酸塩の合成ルート
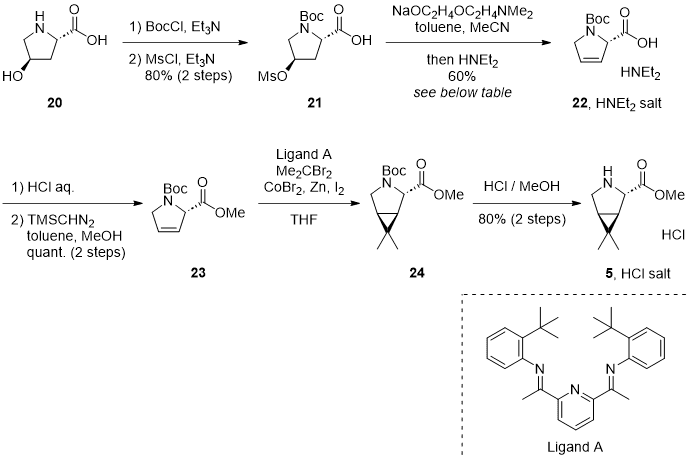
他にもコバルト触媒を用いた短工程での5 の塩酸塩の製造 (200 kg/batch) にも成功しています。20 を出発原料とし、Boc保護と水酸基の脱離基への変換により、カルボン酸21 を得ます。続いて塩基を用いた水酸基の脱離により、オレフィン22 をジエチルアミン塩として得ます5 。この脱離反応はオレフィンの生成位置が異なる異性体が生成しますが、種々検討することで、最適な条件を見つけています(後述)。22 をメチルエステル23 へと誘導6 した後、23 のオレフィンのシクロプロパン化7 により、目的とする立体化学を有する24 を得た後、脱Bocし5 の塩酸塩へと誘導しています1 。
Scheme 3 コバルト触媒を用いた短工程での5 の塩酸塩の合成ルート
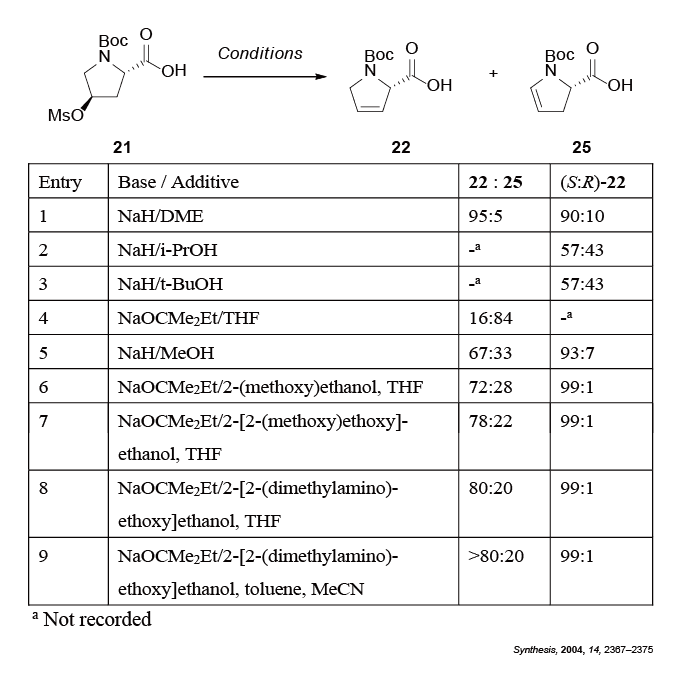
21 →22 での変換では、塩基の選択が重要でした。最初に水素化ナトリウムをDME溶液中で作用させたところ、目的の22 がラセミ化をある程度抑制しつつ得られました(entry 1)。しかしながら、スケールアップすると再現性が得られなかったことから条件を検討しなおすことにしました。2級アルコール及び3級アルコールのナトリウムアルコキシラートを作用させると完全にラセミ化しました (entry 2, 3)。嵩高い1級アルコールを作用させると望ましくない異性体25 が主に生成しています(entry 4)。ナトリウムメトキシドを作用させた場合は、ラセミ化は抑制されたものの、異性体比はentry 1よりも低下しています (entry 5)。さらに1級アルコールを検討したところ (entry 6~9)、entry 9の条件が最良であることが判明しました。Entry 9で使用するアルコキシラートは3級アミンでもあるため、酸性条件下での後処理により容易に除去できるため、操作性にも優れています5 。
Table 1 21 →22 の変換における塩基の条件検討
出典ACS Cent. Sci. , 2023 , 9 , 849–857J. Am. Chem. Soc. , 2012 , 134 , 6467–6472Synthesis , 2004 , 14 , 2367-2375Angew. Chem. Int. Ed. , 2018 , 57 , 13902-13906
次回は、保護アミノ酸11 とアミン4 の塩酸塩の合成について紹介します。
part 1 part 3
研究開発部 深澤です。「R&D化学ネタ」今回は、私が参加しポスター発表したACS Spring 2023の講演から注目した内容をご紹介します。”Nirmatrelvir (COVID-19 治療薬)”です。
ポスター発表 ニュースリリース
Nirmatrelvir (PF-07321332, 1 ) はPfizer社が開発したCOVID-19 治療薬です。FDAからは2021年12月に緊急使用許可が出され、日本では2022年2月に特例承認されました。日本では、商品名”パキロビッドパック”として販売されています。1 ) の第I相臨床試験の結果が公表されました1 。
Scheme 1 メディシナルルート
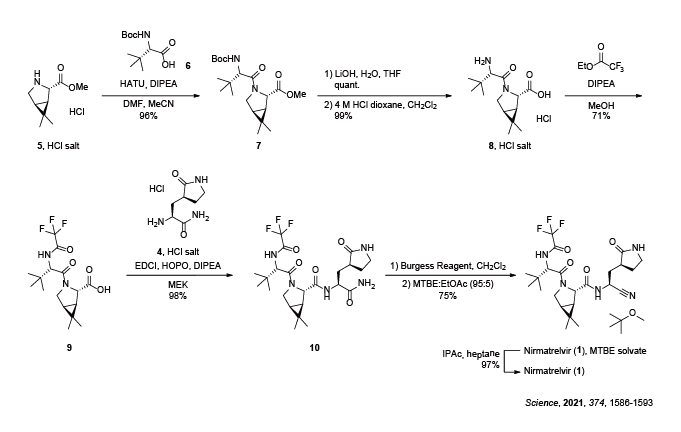
二環式ピロリジン誘導体5 の塩酸塩とBoc保護されたアミノ酸6 とのHATUを用いた縮合により、アミド7 を得た後、メチルエステルの加水分解及びBoc基の除去によりアミン8 の塩酸塩を得ます。続いて、トリフルオロ酢酸エチルを作用させ、トリフルオロアセトアミド9 へと変換した後、4 の塩酸塩との縮合により、アミド10 を得ます。最後に、C末端アミドのBurgess試薬を用いた脱水反応の後、MTBEと酢酸エチルの混液から結晶化させることで、Nirmatrelvir (1 ) のMTBE和物を得ます。そのMTBE和物をIPAc/heptane混液から晶析させることで、Nirmatrelvir (1 ) が得られます。
Nirmatrelvir (1 ) が、COVID-19の治療薬として使用できる見込みが立ったため、実製造に適した合成法を検討することになりました。6 の代わりに保護基の変換が必要とならないトリフルオロアセチル基で保護されたアミノ酸11 を使用することとし、3つのフラグメントからNirmatrelvir (1 ) を合成する経路へと変更しています2 。
Scheme 2 実製造においてNirmatrelvir (1 ) を構成する3つのフラグメント
出典Science , 2021 , 374 , 1586-1593ACS Cent. Sci. , 2023 , 9 , 849–857
次回は、この3つのフラグメントの合成経路をご紹介します。
part 2
研究開発部 深澤です。HAMARIでは,得られた研究成果を積極的に学会等で発表していますが、2023年3月、ACS Spring 2023でポスター発表をしてきました。
ポスター発表 ニュースリリース
【Title】 Rapid and efficient syntheses of tryptophans using continuous-flow quaternization-substitution reaction of gramines with a chiral nucleophilic glycine equivalent
HAMARIが力を入れて取り組んでいるフロー合成の成果を、ようやく海外の学会で発表出来て感慨深いです。
ポスターと私
ポスター発表は学会の2日目と3日目の夜の計2回実施し、様々な方に質問やコメントを頂きました。
発表内容はこちらからダウンロードできます。
発表内容をダウンロード
おまけ
会場に設置されていた看板 多くの人が目の前に立って記念撮影をしていました。
看板の裏側 ホワイトボードになっており、来場者が気軽に書き込めるようになっていました。写真は1日目夕方。
今回はHAMARIの加湿脱溶媒手法についてご紹介します。
原薬製造現場の乾燥工程において、残留溶媒が低減できない・減圧乾燥での再現性が得られない・乾燥状態の化合物安定性が悪いなどの問題が発生する場合があります。
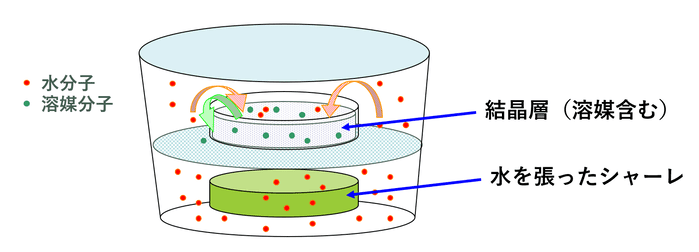
しかしながら、従来手法による棚段乾燥機を用いた調湿乾燥では、実機における湿度の保持・均一性の確保・乾燥終点の管理が難しく、スケールアップが困難であることが大きな課題でした。
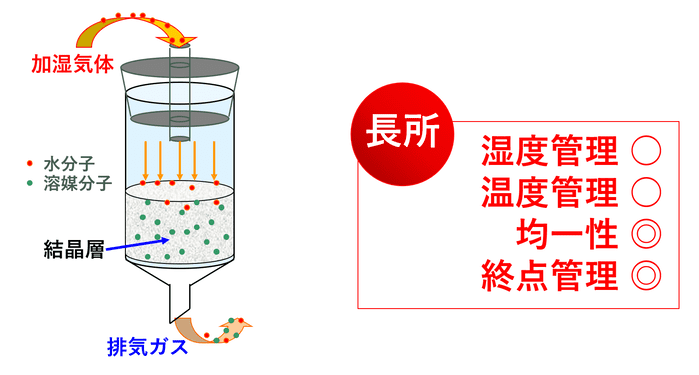
そこで弊社では改良手法として、ろ過乾燥機を用いる加湿脱溶媒法を採用しています。
弊社での加湿脱溶媒の実施例として、残留溶媒≧3000ppmの原薬Aを加湿脱溶媒した後、置換した水分を減圧乾燥で除去することにより、不純物の増加を抑えつつ残留溶媒<200ppmまで低減した事例があります。
弊社では、湿度・温度・流速の調整が可能な自社設計の調湿装置を保有しています。
実際に加湿脱溶媒を適用する際には、対象化合物の物性・品質に関するアセスメント、通気する気体の湿度・温度・流速などのパラメータ検討、乾燥終点管理のための条件設定が必要となります。
お問い合わせ
研究ブログ一覧はこちらよりご覧ください。
研究blog