HAMARIの研究開発部門が注目する合成法をご紹介します。
第2回は”SITAGLIPTIN (DPP-4阻害薬)”です。
Sitagliptin (1) は米国Merck社によって開発されたDPP-4 (dipeptidyl peptidase-4) 阻害剤です。1は2型糖尿病に対する治療薬として米国において2006年10月にFDAにより承認されました。日本でも2009年10月に承認されて、“JANUVIA (ジャヌビア)” 及び “GLACTIV (グラクティブ)” のブランド名 (共に1のリン酸塩一水和物) で販売されています。また、sitagliptin (1) は、数あるDPP-4阻害剤(gliptin)の中で、2型糖尿病治療薬として最も多く用いられており、代表的なブロックバスターの1つです (Global sales in 2020: $5,276 million)。
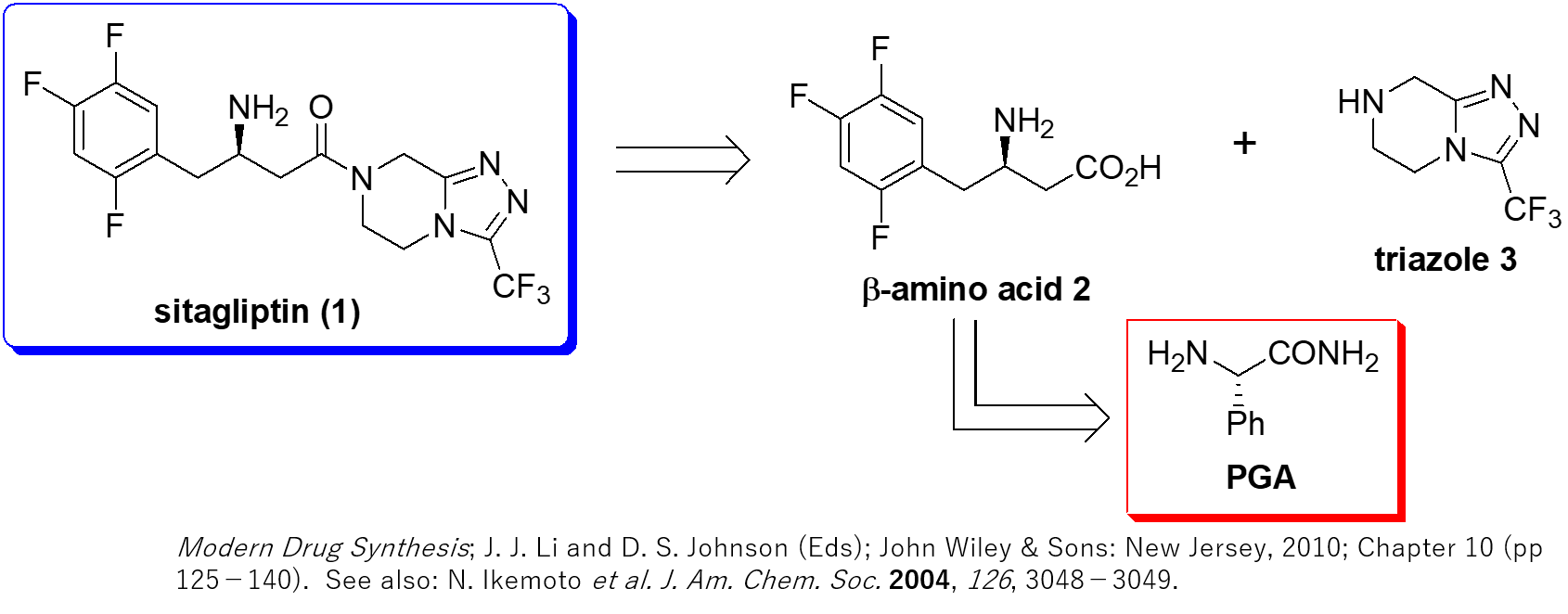
Merck社の研究チームによって開発された、sitagliptin (1) の合成法 (the 2nd generation synthesis)では、入手容易で比較的安価なL-フェニルグリシンアミド(PGA)が巧みに利用されています。PGAは、本合成法において1の構成ユニットであるβ-アミノ酸2のアミノ基供与体であるとともに、その不斉中心を導入するためのキラル補助基として働いています。
本合成法の鍵となる反応は、β-ケトエステル4とPGAとの縮合反応により得られたエナミノエステル5を基質としてAdams触媒 (PtO2) を用いる不均一系でのジアステレオ選択的水素化反応です。本反応により、β-アミノエステル6が非常に高いジアステレオ選択性 (91% de) で収率良く得られています。ここでPGAをキラル補助基として用いることで、この種の反応で汎用されるα-メチルベンジルアミン (PGAのCONHH2基がメチル基に置き換わった化合物) から誘導されるエナミノエステルの水素化反応と比較して、はるかに高いジアステレオ選択性が達成されています。
目的物1への変換は、エステル6の加水分解とそれに続くトリアゾール3とのアミド化反応により7へと誘導し、続いて、PGAに由来するキラル補助基をPd触媒下に加水素分解することにより効率良く達成されています (Scheme 1) 。
 Scheme 1
Scheme 1
さらに、ジアステレオ選択的水素化反応の基質として、トリアゾールユニット3を導入したβ-ケトアミド8とPGAとの縮合反応により得られるエナミノアミド9を用いると、β-アミノアミド10の収率及びジアステレオ選択性がさらに向上しています(それぞれ92%及び97.4% de)。最後に、10を水素移動型還元条件下にPGA由来の保護基を除去し、さらにL-酒石酸で光学分割することにより、光学的に純粋なsitagliptin (1)・L-酒石酸塩が高収率で得られています(Scheme 2)。
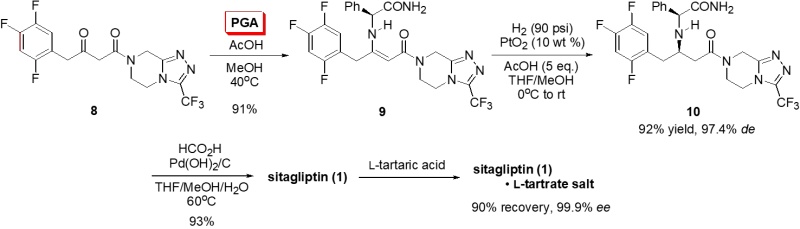 Scheme 2
Scheme 2
なお、トリアゾール3の合成はMerck社の研究チームによってScheme 3に示す方法(Org. Lett. 2005, 7, 1039−1042)により、また、β-ケトアミド8の合成もフェニル酢酸誘導体11、Meldrum酸12及びトリアゾール3の高収率・効率的な3成分反応により達成されています(J. Am. Chem. Soc. 2004, 126, 13002−13009)。
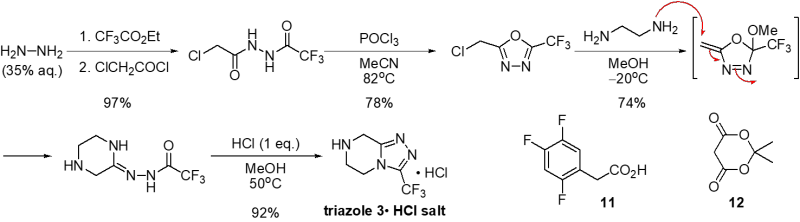 Scheme 3
Scheme 3
<参考>
Sitagliptin (1) の上記合成法においてL-フェニルグリシンアミド(PGA)は、①アミノ基供与体、及び、②キラル補助基として活用されていますが、本合成法に先立って同様の目的のためにPGA(以下の例では鏡像体であるD-PGAを使用)は、以下のような例に用いられています。
(1)ジアステレオ選択的Strecker合成によるL–tert-ロイシンの合成(Org. Lett. 2001, 3, 1121−1124)
(2)アリル亜鉛反応剤のイミンへのジアステレオ選択的付加反応を用いるキラルなホモアリルアミン類の合成(Org. Lett. 2001, 3, 3943−3946)
(3)ジアステレオ選択的水素化反応を用いる(S)-1-アミノインダンの合成(Tetrahedron: Asymmetry 2003, 14, 3479−3485)
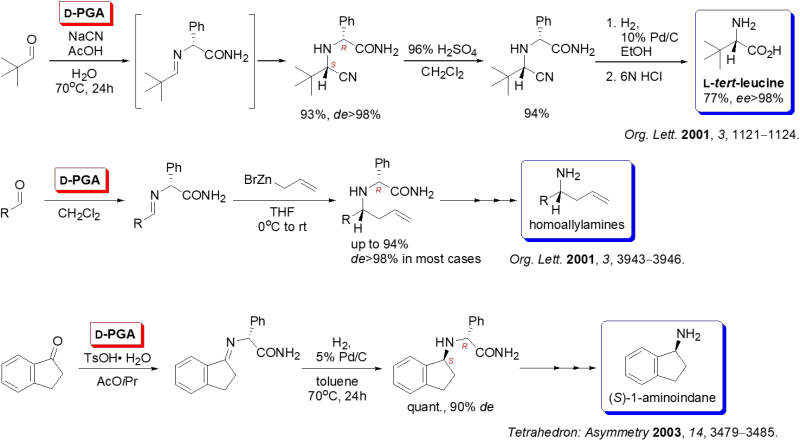 Scheme 4
Scheme 4
HAMARIの研究開発部門が注目する合成法をご紹介します。
第1回は”UBROGEPANT (片頭痛治療薬)”です。
Ubrogepant (MK-1602, 1)は、2019年12月にFDAにより承認された、最初の経口投与可能なCGRP(カルシトニン遺伝子関連ペプチド)受容体の選択的拮抗薬であり、片頭痛の急性期治療薬として、現在米国で用いられています。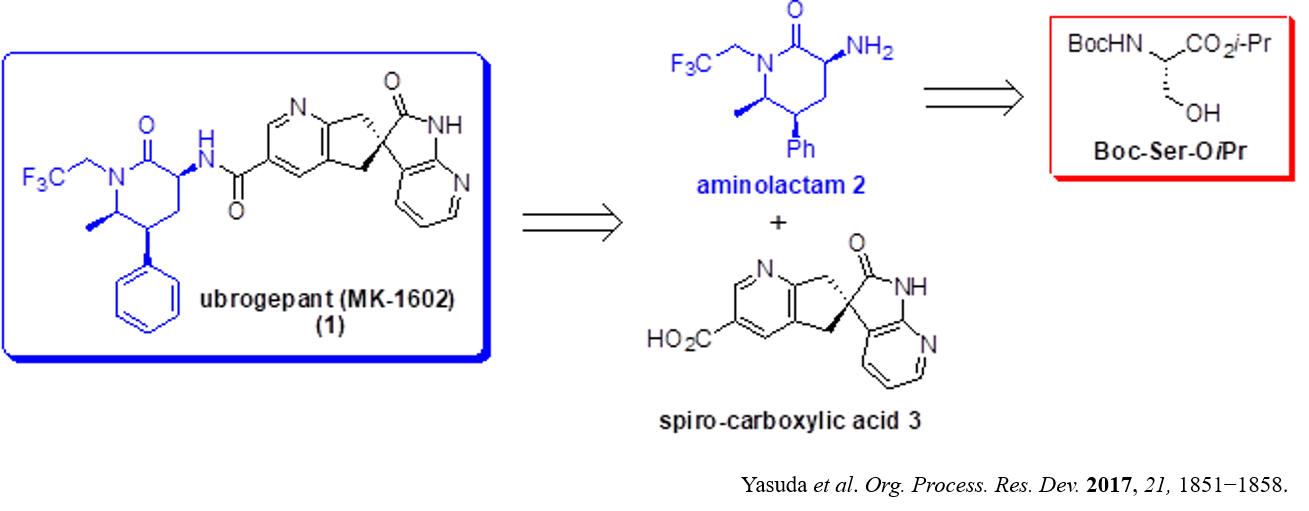
Ubrogepant (1)の合成に関して、2017年にMerck社の安田修祥(やすだのぶよし)博士を中心とする研究チームにより、実用的な大スケール合成法が報告されています(Org. Process Res. Dev. 2017, 21, 1851−1858)。鍵となる2種のフラグメント2及び3のうち、3つのキラル中心を有するアミノラクタム2の原料としてセリン誘導体が用いられており、キラル中心の立体化学の制御は、5位及び6位では熱力学的支配による動的速度論的トランスアミノ化反応(dynamic kinetic transamination, DK-TA)により、また、3位は異性化晶析法(crystallization-induced diastereomeric transformation, CIDT)を適用することにより効率よく達成されています。

アミノラクタム2の合成法の概略は以下のとおりです。
N-Boc-L-セリンイソプロピルエステルが出発物質として用いられ、その水酸基のメシル化とそれに続く塩基処理により、デヒドロアラニン誘導体4へと変換されています。続いて、Cs2CO3存在下に生じるフェニルアセトンのエノラートアニオンと4との共役付加反応により、酵素反応基質である付加体5が異性体混合物として得られています。
鍵反応であるトランスアミノ化反応では、種々のトランスアミナーゼを用いたスクリーニングと反応条件の詳細な検討、さらにはタンパク質工学の手法を駆使して立体選択性及び反応性に優れた酵素変異体SEQ ID: 1を調製すること成功しました。ホウ酸緩衝液(pH 10.5)中で補酵素PLP存在下にi-PrNH2をアミノ基供与体として、トランスアミナーゼ変異体SEQ ID: 1を触媒とするトランスアミノ化反応により、基質5から目的とする(5S,6R)体が高立体選択的及び高収率で得られ、系中でのラクタム化反応を経由してN-Boc-アミノラクタム6へ誘導されています。6の段階では、3位の立体配置がβ/α = ca. 1.2/1であるジアステレオマー混合物ですが、この位置の立体化学制御は最終段階においてN-Boc基の脱保護後に目的の立体配置に異性化されています。
次工程である6の1位窒素原子のアルキル化反応では、条件検討による最適化条件(CF3CH2OTf, LiOt-Bu/THF, subambient temperatures)下でも目的物7に少量のジアルキル化副生物8及び原料6が混在する混合物として得られていますが、これらの不純物は、初めの酸処理条件(3N HCl, TBAB, toluene, 35℃)による原料6のN-Boc基の選択的除去、続く2段階目の酸処理条件(4.5N HCl, MTBE/MeOH, 50℃)による、目的物7のN-Boc基の選択的脱保護(ジアルキル化体8は未反応のまま残存)という、2段階の脱Boc化反応を巧みに用いることにより、単純な分液操作によって不純物である8及び6を除去した純粋な目的物9(3位の立体配置はβ/α = 4/1)が得られています。最後に、触媒量の3,5-dichlorosalicylaldehyde存在下にp-toluic acidによる異性化晶析法(CIDT)を適用することにより、3位の立体化学を望みのβ配置にほぼ完全に異性化させることに成功し、目的とするアミノラクタム2をp-toluic acidとの塩として高立体選択的及び高収率で得ています(86%, 99.6% de)。

なお、本論文では安田博士らにより独自に見出された新規な二重4級塩化Cinchonaアルカロイドを相間移動触媒(PTC)として用いるキラルなスピロカルボン酸誘導体3の画期的な合成法も併せて報告されています。
HAMARIでは、フロー合成による連続生産を医薬品原薬の製造に活かせないか、2016年より検討を行っています。
HAMARIのフロー合成 ご紹介
その成果のひとつを、6月の日本プロセス化学会2021サマーシンポジウムにて発表する事ができました。
現在、発表内容のダイジェスト動画を作成中、近日中にWebで公開致します。
お楽しみに!










